今年的 ESMO 年会依旧在线上举办。按照惯例,还是将可能影响临床实践的研究梳理一遍,分为肝细胞癌和胆道系统肿瘤(包括了肝内胆管癌)两个部分。

肝细胞癌
中期肝癌:介入 + 纳武利尤单抗的II期研究(IMMUTACE)(LBA37)
这是肝细胞癌领域的唯一一项口头报告。这是在德国开展的一项多中心研究,评价的是在中期肝癌在介入治疗的基础上增加纳武利尤单抗治疗的疗效和安全性。患者接受了最多2次 TACE 治疗,在第一次 TACE 治疗后的 2-3 天即加上了纳武利尤单抗治疗。研究一共入组了 49 例患者,中位肿瘤直径 3 cm、中位肿瘤数目是 3 枚。疗效数据看起来还不错,ORR 71%,中位 PFS 6.14 月,初步的中位 OS 28.32 月。G3 及以上治疗相关 AE 发生率 34.7%。
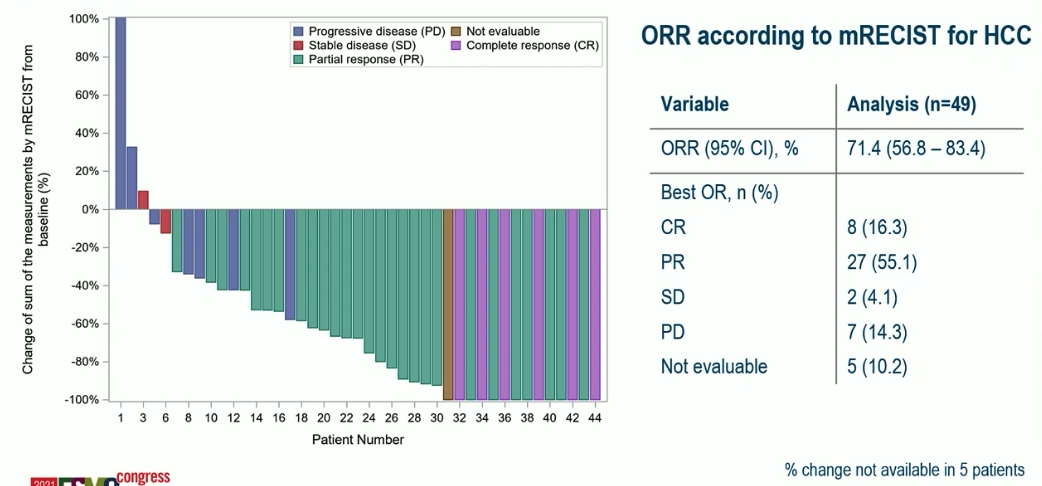
目前有好几项在介入治疗基础上增加药物治疗的 III 期研究正在进行,例如 LEAP-012、CheckMate 74W、EMERALD-1 等等,期待这些研究结果的揭晓。
晚期肝癌:KN046 + 仑伐替尼的II期研究(938P)
KN046 是国内康宁杰瑞开发的一个针对 PD-L1 和 CTLA-4 的双特异性抗体。这项研究里评价将其用于与仑伐替尼联合,一线治疗晚期肝癌的疗效和安全性。目前累积了 21 例可评估患者,疗效数据不错,RECIST v1.1 和mRECIST 标准评估的 ORR 分别达到了 57% 和 76.2%。安全性数据同样显得太好了,G3 及以上 AE 发生率只有 20%,其中与 KN046 相关的 G3 AE 发生率 8%。
国内康方公司也有个类似的双特异性抗体,AK104,今年 ASCO 上也公布了一个相似研究的数据,入组样本量19,RECIST v1.1评价的 ORR 44.4%。整体而言,这两个研究样本量都太小了,以至于疗效和安全性数据应该还没能稳定下来,因为仑伐替尼单用的 G3 及以上不良事件发生率也不会只有 20%。
晚期肝癌:肝动脉灌注化疗 + 仑伐替尼的 II 期研究(LEOPARD)(937P)
这项来自于日本的多中心研究使用的是顺铂作为肝动脉灌注化疗(HAIC)的药物,跟国内广泛使用的 FLOFOX 方案不同,入组的是未经系统治疗的晚期肝癌患者。目前累积了 34 例可评估患者,RECIST v1.1 和 mRECIST 标准评估的 ORR 分别为 45.7% 和 64.7%,中位 PFS 和中位 OS 分别为 6.3 月和 17.2 月。这项研究显示,HAIC 治疗的基础上加上仑伐替尼,疗效数据会有一些提升,但总体的 OS 数据并不是特别吸引人,也许化疗起效比较快,耐药也会比较快。
近期,国内有多家中心报道了 HAIC+ TKI + PD-1 抗体联合治疗的数据,ORR 一般在 60% 以上,但还缺乏长期生存的数据。
晚期肝癌:HAIC+阿帕替尼+卡瑞利珠单抗的 II 期研究(TRIPLET)(946P)
这是来自国内中山大学肿瘤防治中心的一项单中心研究,评估的是 BCLC C 期肝癌患者中一线使用 FOLFOX 方案的肝动脉灌注化疗加上双艾组合的疗效和安全性。研究一共入组了 26 例患者,RECIST v1.1 和 mRECIST 标准评估的 ORR 分别为 61.54% 和 76.92%,两个标准评估的疾病控制率为 92.31%。6 月 PFS 率为 73.7%,1 年生存率则高达 90.7%。G3 及以上 AE 的发生率为 69.23%。期待扩大样本量、进一步随访、多中心验证的结果。
可切除肝癌:阿帕替尼+卡瑞利珠单抗辅助治疗的单中心研究(944P)
这是来自我们中心(复旦大学肝癌研究所)的一项单中心、单臂研究,在接受了手术切除的中国肝癌分期 II-III 期(相当于 BCLC B-C 期)的患者中评价双艾组合用于辅助治疗的疗效和安全性。研究一共入组了 45 例患者,其中 II 期和 III 期患者分别为 25 和 20 例,中位随访 21.5 月后,中位 RFS 为 11.7 月,1 年 RFS 和 OS 率分别为 48.9% 和 97.8%;2 年 RFS 和 OS 率分别为 41.0% 和 75.7%。与我们中心的历史数据相比,RFS 和 OS 的数据有一定程度的提升。目前双艾组合用于肝癌术后辅助治疗的 III 期对照研究(325 研究)正在开展,各家中心也在纷纷入组受试者。
晚期肝癌:Bavituximab+帕博利珠单抗的 II 期研究(939P)
Bavituximab是一个磷脂酰丝氨酸抗体。磷脂酰丝氨酸是细胞膜的一种成分,当细胞转化为癌细胞时,会暴露出来。此外,靶向这个靶点还有一些免疫调节作用。这项研究入组的是未经系统治疗的肝癌患者,目前一共入组了 18 例患者,ORR 为 31.3%,DCR 为 56.3%。初步的数据表明,这个药物还是有一定的抗肿瘤活性(看起来超过了帕博利珠单抗单独应用的疗效),此外安全性数据看起来也可以接受。
胆道系统肿瘤
伊立替康脂质体+5-FU(nal-IRI/5-FU/LV)+亚叶酸 vs 吉西他滨+顺铂的 II 期研究(AIO NIFE)(LBA10)
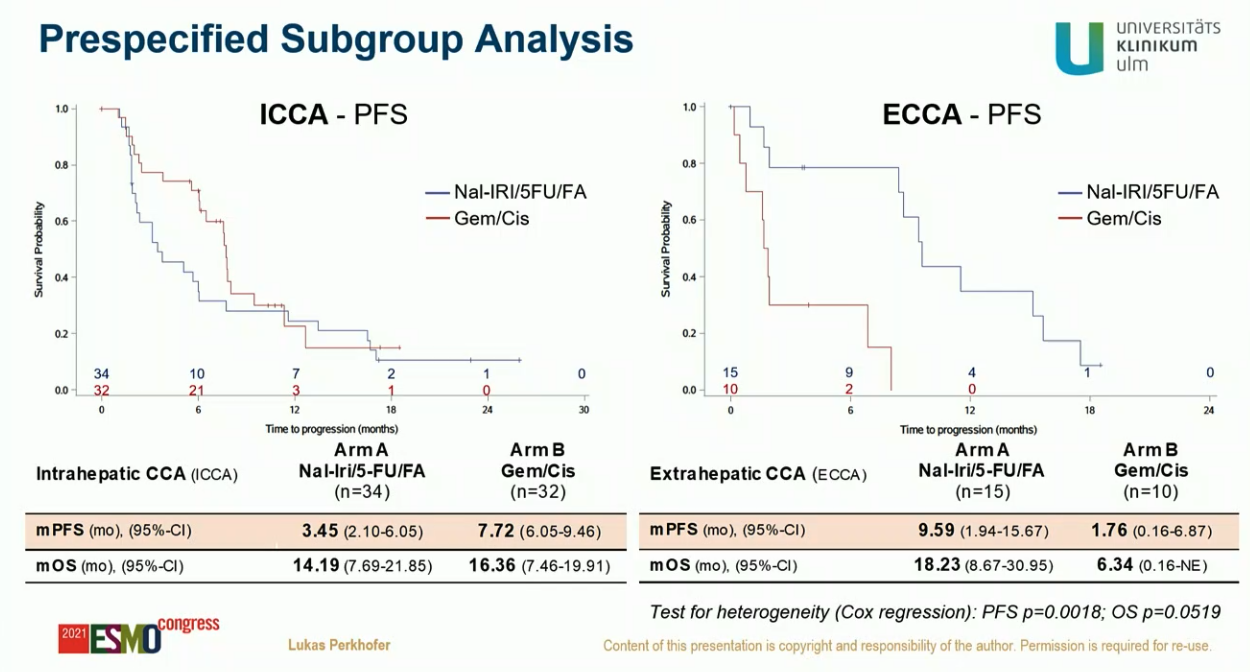
一直以来,吉西他滨+顺铂(GC 方案)化疗是不可切除胆道系统肿瘤的一线治疗首选,也有过很多尝试,试图在疗效上超越 GC,但大多没有成功。这是一项将 nal-IRI/5-FU/LV 方案和 GC 方案做头对头对比的 II 期研究。在德国的 21 家中心入组了 93 例患者,两组中位 PFS 分别为 5.98 月和 6.87 月。其中,肝内胆管癌的中位 PFS 分别为 3.45 月和 7.72 月,肝外胆管癌的中位 PFS 则分别为 9.59 月和 1.76 月。ORR 分别为 24.5% 和 11.9%,初步的中位 OS 分别为 15.9 月和 13.63 月。没看到安全性数据的对比。尽管研究还比较初步,对于胆道系统肿瘤而言,使用这个新方案没有特别出彩的地方,除非存在吉西他滨或者铂类禁忌,否则还是乖乖使用吉西他滨+铂类的化疗作为一线治疗吧。研究者对于将这个方案用于肝外胆管癌还是比较乐观的,但我觉得有些过度乐观了,一方面肝外胆管癌的亚组样本量过小,结论很不可靠;而且 GC 化疗组效果也不至于这么差,中位 PFS 只有 1.76 月,这个结果显然是样本量太小带来的不稳定结果。
吉西他滨+S1+纳武利尤单抗用于胆道系统肿瘤的一线治疗(49P)
这项来自中国台湾的多中心、单臂研究,总共入组了 48 例患者,疗效方面,ORR 41.7%,疾病控制率为 77.1%(包括CR、PR 和 SD 12 周以上)。中位 PFS 8 月,中位 OS 未达到。不良事件的发生率也比较低,3-4 级化疗相关的 AE 发生率 7%,3 级免疫相关的不良反应 1 例。介入这么好的疗效和AE发生率,这个方案还是值得一试的。但是,我们医院肿瘤科在去年的 ESMO 上报道了一组数据,使用的是吉西他滨+S1+特瑞普利单抗,疗效数据没有这么好,那项研究里,ORR 是 20.6%,中位 PFS 是 6.7 月。
mGEMOX + 瑞戈非尼 vs mGEMOX 用于胆道系统肿瘤的一线治疗(48P)
这项也是来自于中国台湾,研究使用的是修改版的 GEMOX 方案,在这个基础上增加了瑞戈非尼口服,160 mg/d,使用 2 周停药 1 周。一共入组了 63 例患者,按照 2:1 的比例随机接受 mGEMOX+瑞戈非尼联合治疗或单用 mGEMOX 化疗,中位 PFS 分别为 7.82 月和 7.23 月,ORR分别为 33.3% 和 21.7%,中位 OS 分别为 13.5 月和 15.1 月。整体而言,在化疗基础上增加了瑞戈非尼,提高了肿瘤缓解率,但并未改善 PFS 和 OS。
FGFR2 变异在中国的肝内胆管癌患者中的流行率数据(53P)
尽管针对 FGFR2 融合或重排的药物有好几个,但存在这个靶点变异的患者到底有多少并没有翔实的数据。以往的报道显示,肝内胆管癌存在这样变异的比例达到了 15% 左右,但以我们的经验看并没有这么多。这项也是我们中心牵头的一项全国多中心的研究,共测试了 728 例肝内胆管癌患者的 FGFR2 的变异/融合,发现比例只有 6.14%。在地域分布上,西南地区(四川和云南)的比例似乎稍高,达 10.5%,南方稍低(广东和广西),为5% 。
FGFR2融合/重排胆管癌:培米替尼(pemigatinib)用于中国胆道系统肿瘤患者的数据(50P)
借助 FIGHT-202 研究的结果,pemigatinib 在美国获批上市,用于合并 FGFR2 融合或重排的胆道系统肿瘤的二线治疗。这项研究是我们中心周俭教授牵头的一项多中心注册研究,是 FIGHT-202 研究在国内的桥接试验。研究一共入组了 30 例患者。疗效方面,中心影像评估的 ORR 达到了 50%,DCR 达到了 100%,这些疗效数据超过了全球人群。此外,中位PFS 6.3 月,G3 及以上的治疗相关 AE 发生率 14.7%。借助这个桥接试验,信达生物已经在寻求将 pemigatinib 在国内上市。虽然这样的患者比例比较低,上市后售价也不会低,但却能改变了国内的这类患者无药可用的窘境。
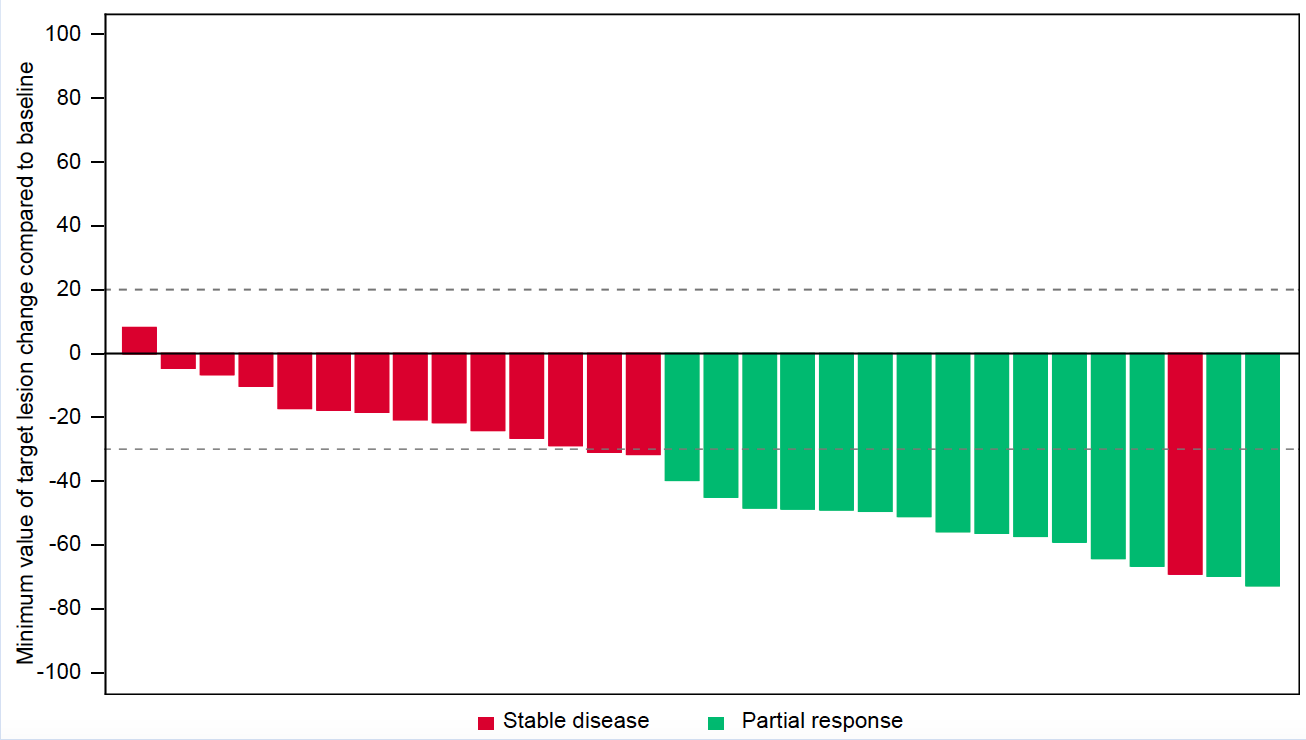
FGFR2融合/重排胆管癌:derazantinib的初步疗效(47P)
Derazantinib 也是一个强效的 FGFR1-3 抑制剂,这项研究里评估这个药物用于胆道系统肿瘤后线治疗的疗效和安全性。一共入组了 103 例患者。疗效方面,ORR 21.4%,DCR 74.8%,中位 DOR 6.4 月。中位 PFS 7.8 月,中位 OS 15.5 月。在 2 线和 3+ 线患者中,ORR 差别不大,分别为 21.8% 和 20.8%。
感谢卫材公司医学部郭海军经理提供学术支持。
