今年的 ESMO 算是肝癌研究的大年,有 3 项晚期肝癌的一线治疗的研究公布数据,前面已经介绍过了 LEAP-002(仑伐替尼+帕博利珠单抗 vs 仑伐替尼+安慰剂)(#LBA34)、SHR-1210-III-310 (阿帕替尼+卡瑞利珠单抗 vs 索拉非尼)(#LBA35),还有这一项 RATIONALE-301(替雷利珠单抗 vs 索拉非尼)(#LBA36)研究。
这是一项国际多中心的随机对照试验,入组的是未经系统治疗的不可切除或晚期肝癌患者。研究一共入组了 674 例患者,按照 1:1 的比例随机接受替雷利珠单抗或索拉非尼治疗。
研究采用的是非劣效设计,OS 是唯一的主要研究终点。 在至少随访 33 月后,替雷利珠单抗和索拉非尼组的中位 OS 分别为 15.9 月和 14.1 月(HR=0.85,95.003% CI 0.712-1.019),置信区间上限低于了预先设定的非劣效界限 1.08,所以该研究达到了主要研究终点。
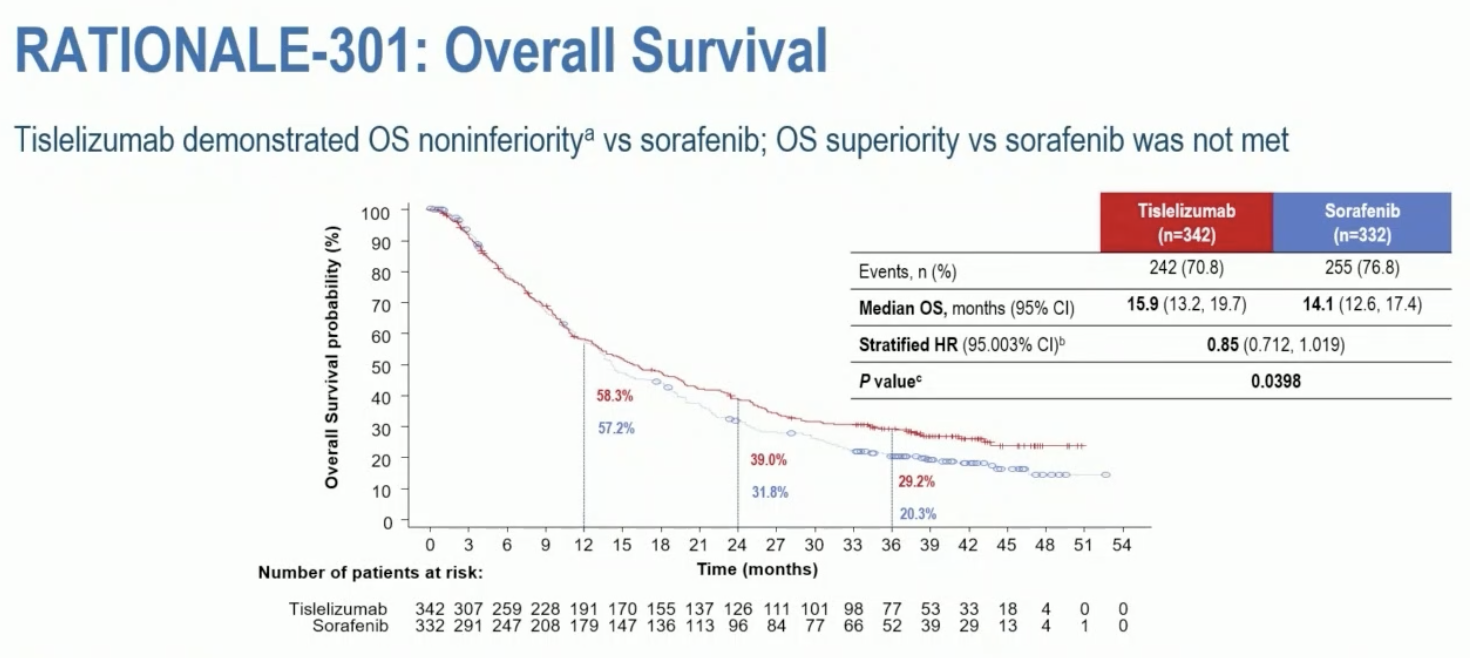
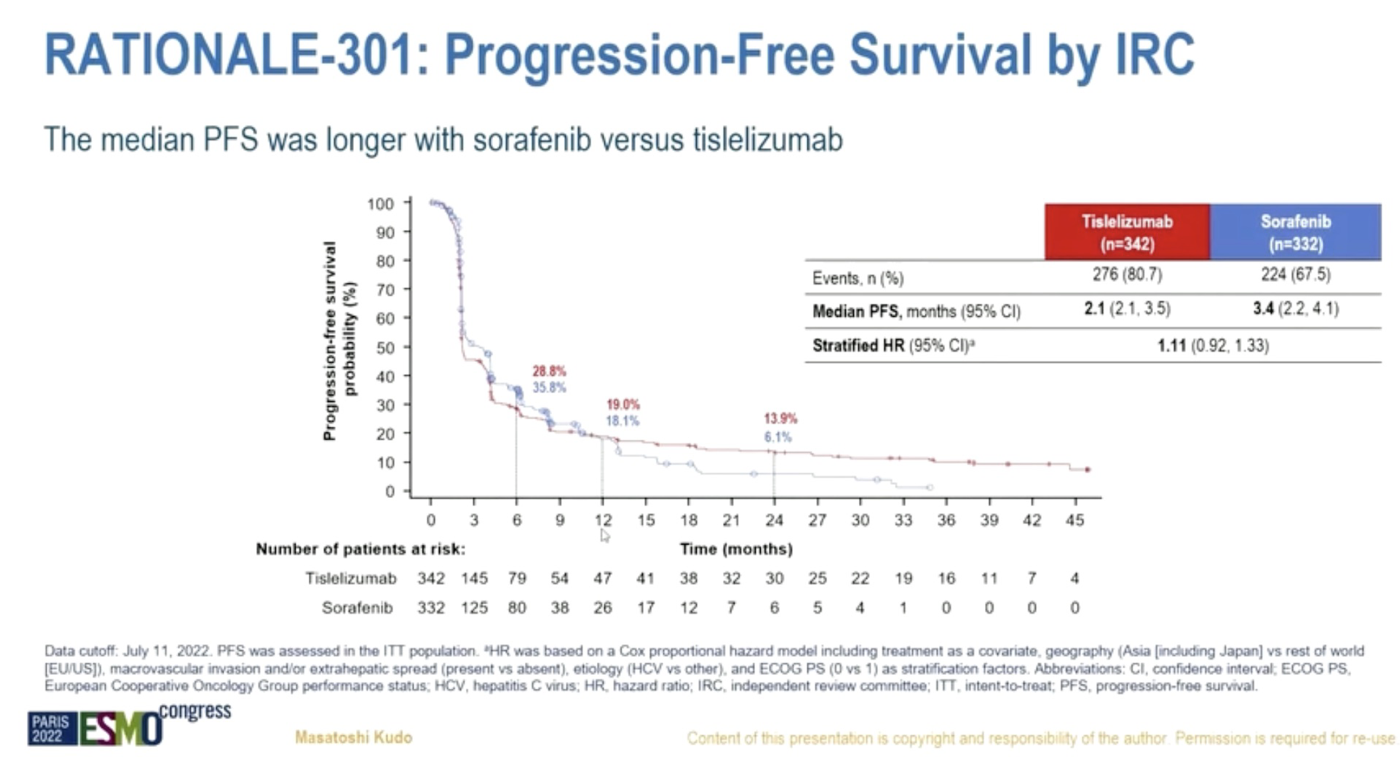
此外,替雷利珠单抗单抗组 ORR 更高(14.3% vs 5.4%),缓解持续时间也更长(36.1 月 vs 11.0 月)。然而,介于免疫治疗的特点,替雷利珠单抗的 PFS 则不及索拉非尼(2.2 月 vs 3.6 月,HR=1.1,95% CI 0.92-1.33)。 虽然替雷利珠单抗的中位 PFS 比不上索拉非尼,但是整条曲线看起来还是在索拉非尼上方,我怀疑这个 HR 值算错了,应该是 1.11 的倒数 😅
不良反应方面则中规中矩,符合 PD-1 抗体单药使用时的安全性。
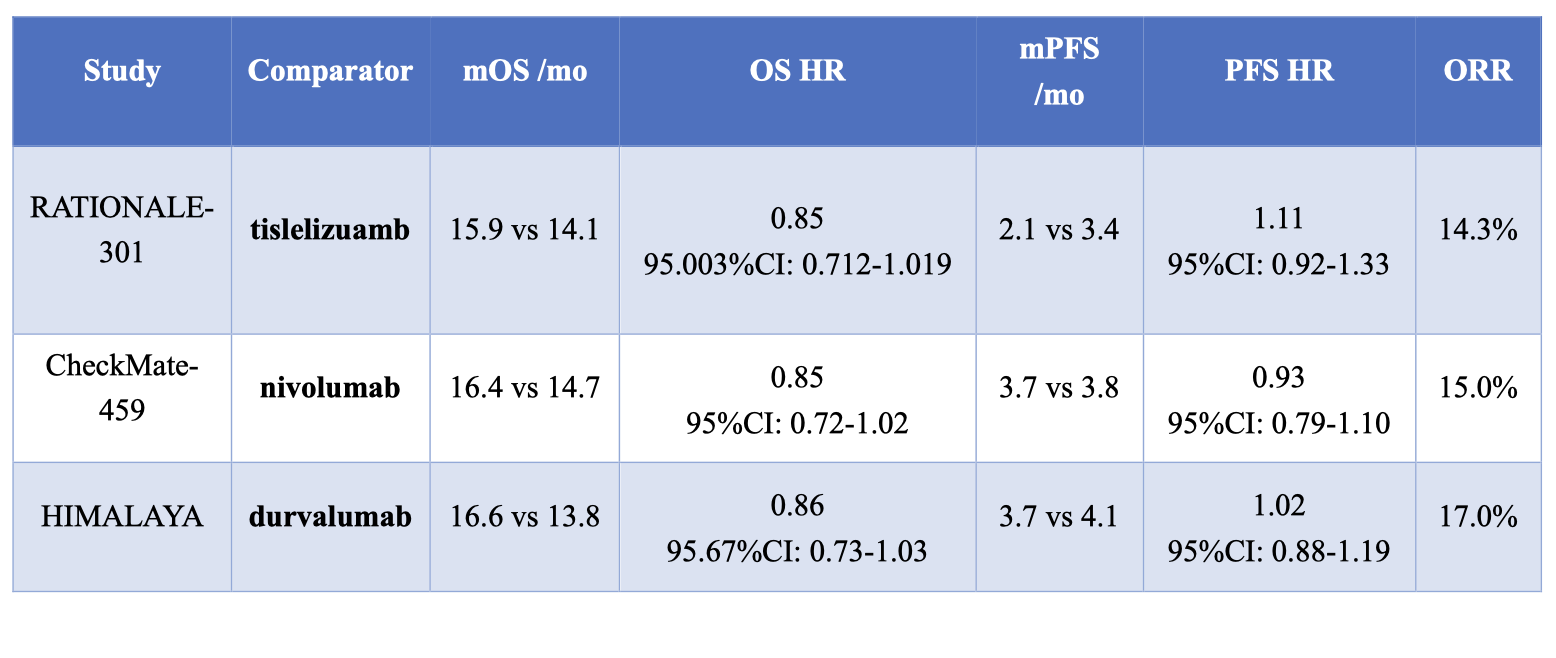
这项研究应该很大程度上吸取了 CheckMate 459 研究(晚期肝癌一线治疗:纳武利尤单抗 vs 索拉非尼),在该研究中,主要终点 OS 方面,纳武利尤单抗和索拉非尼组的中位 OS 分别为 15.2 月和 13.4 月(HR=0.85,95% CI,0.72-1.02,P=0.075)。遗憾的是,纳武利尤单抗作为先驱,研究采用的是优效性设计,从而该研究未达到主要研究终点。 另外,HIMALAYA 研究中,也有度伐利尤单抗(PD-L1 抗体)单独应用的一个分组,也是吸取了 CheckMate 459 研究的教训,也通过非劣效设计达到了研究终点。如果将这 3 项免疫单药治疗的数据做一下对比,可以看到这 3 个药物的疗效数据非常相似,它们都采用索拉非尼作为对照,相对于索拉非尼,OS 方面的获益很相似(HR 在 0.84-0.85 的水平),ORR 也非常相似(15% 左右)。 而仅仅因为纳武利尤单抗采用的是优效性的设计,其他两个药物采用的是非劣效设计,研究成败解释就变得截然不同。
基于这项研究,预计替雷利珠单抗会在国内获批晚期肝癌的一线治疗适应证。 而此前,替雷利珠单抗借助 RATIONALE-208 这项单臂的 II 期研究附条件获批二线治疗的适应证,有了这项研究之后,适应证得到了前移。
目前在临床上,免疫单药治疗的空间非常有限,目前一线治疗已经有了 T+A 方案、双达组合和双艾组合这 3 项优选一线治疗方案,替雷利珠单抗这样的 PD-1 抗体只能用于贝伐珠单抗使用禁忌的患者,例如严重的或未经处理的食管胃底静脉曲张患者。此外,纳武利尤单抗的单臂研究00313-5/fulltext)显示,PD-1 抗体用于 Child-Pugh B 级肝功能的患者,疗效未见明显降低,副作用没有明显增加。因此,替雷利珠单抗一线治疗的最佳适应证人群可能是这类肝功能不佳的患者。此外,如果医保政策允许,跟一些小分子靶向药物联合使用也值得探索的用法。
