HEPATORCH(JUPITER-10/JS001-035-III-HCC)研究是一项由君实生物开展的全国多中心、开放标签的随机对照 III 期临床试验,评估的是 特瑞普利单抗联合贝伐珠单抗 用于晚期肝癌一线治疗的疗效和安全性,对照组是上一代的靶向药物索拉非尼。
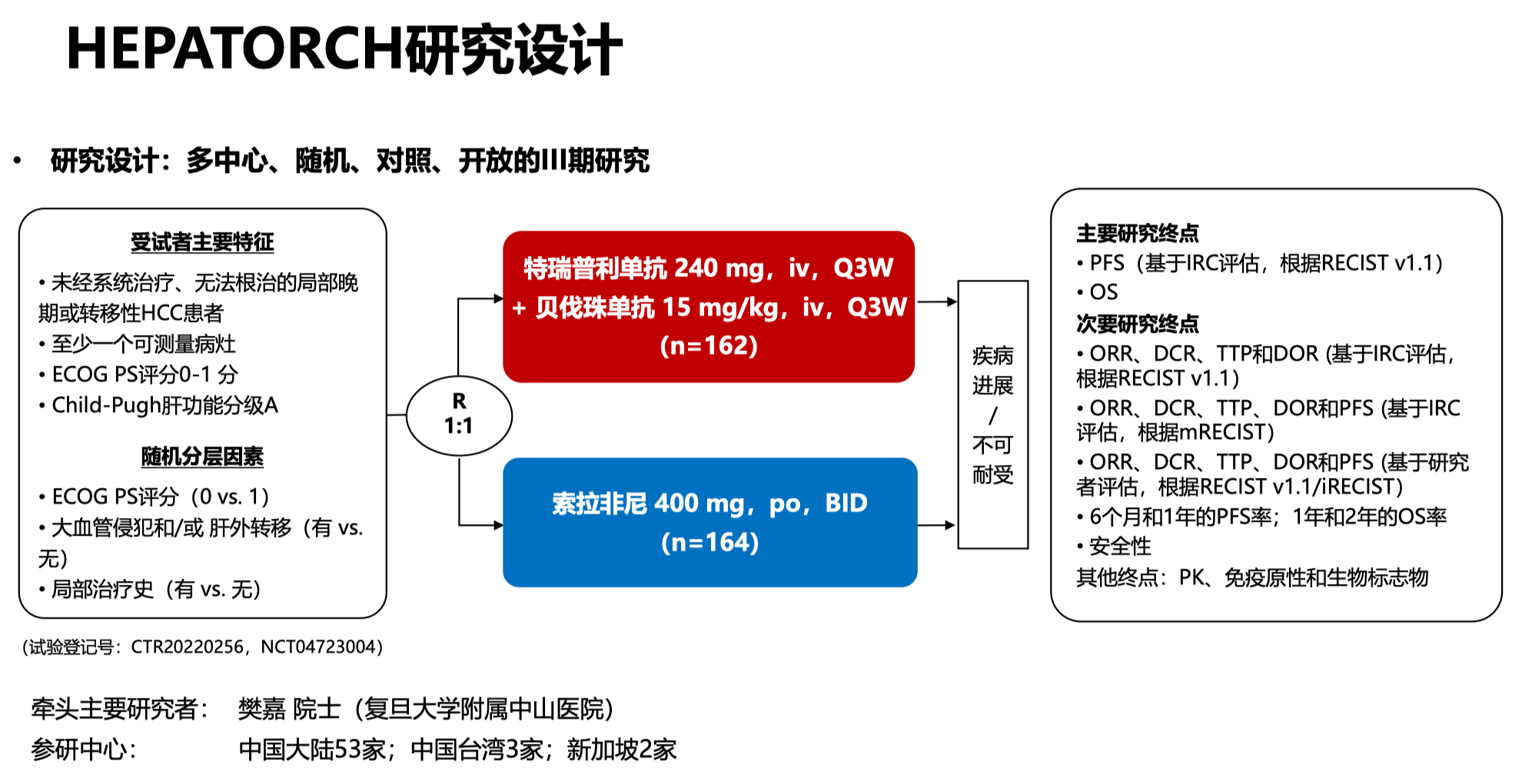
特瑞普利单抗是一个 PD-1 抗体,贝伐珠单抗是 VEGFA 抗体,使用方式分别是 240 mg iv q3w 和 15 mg/kg iv q3w;对照组索拉非尼口服,400mg bid。在今年的 CSCO 年会上,我们中心的史颖弘教授代表研究者做了大会报告,分享了该研究的主要结果。
这项研究主要在中国⼤陆开展,另外还有中国台湾的 3 家中心和新加坡的 2 家中心参与研究。 2020 年 11⽉ ⾄2022 年 1 ⽉期间,总共入组了 326 例未经系统治疗晚期 HCC 患者 ,按照 1:1 的比例随机接受特瑞普利单抗联合⻉伐珠单抗或索拉非尼治疗。
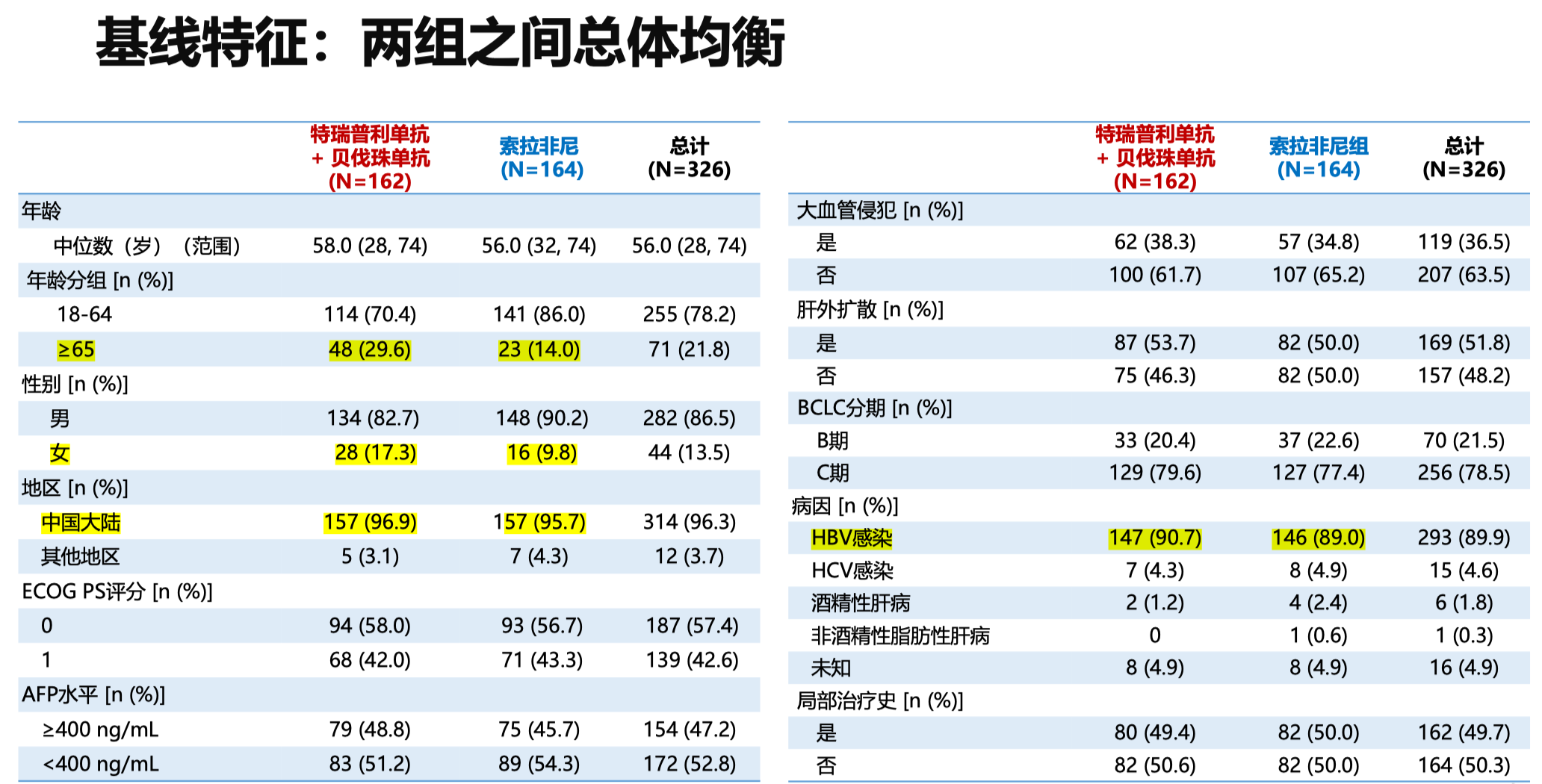
因为是在亚太地区入组的患者,所以 90% 的患者有乙肝感染背景;另外,BCLC C 期患者的比例近 80%,其中合并大血管侵犯的患者占 36.5%,肝外转移的患者占一半以上。因为样本量相对较小, 基线方面,联合治疗组的患者超过 65 岁的比例稍高(29.6% vs 14.0%),男性的比例稍低(82.7% vs 90.2%),其他基线特征基本均衡。
研究采用的是双主要终点设计,两个终点都达到了主要终点:
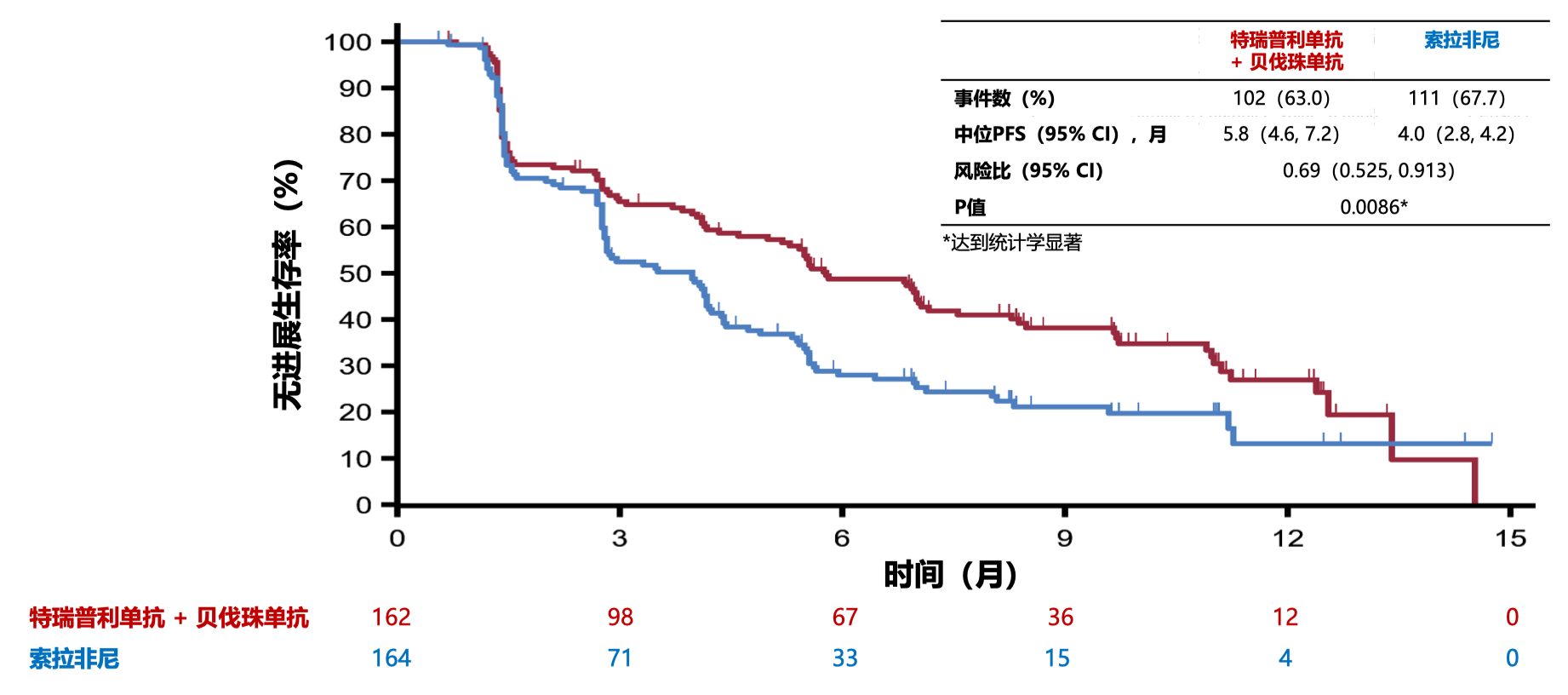
- 无进展生存期(PFS)方面,数据截⾄2022 年 8⽉ ,中位随访时间为 9.4 ⽉,与索拉非尼相比, 特瑞普利单抗联合⻉伐珠单抗显著改善 PFS(中位 PFS 分别为 5.8 月和 4.0 月,HR=0.69,95%CI 0.525-0.913,P=0.0086)。
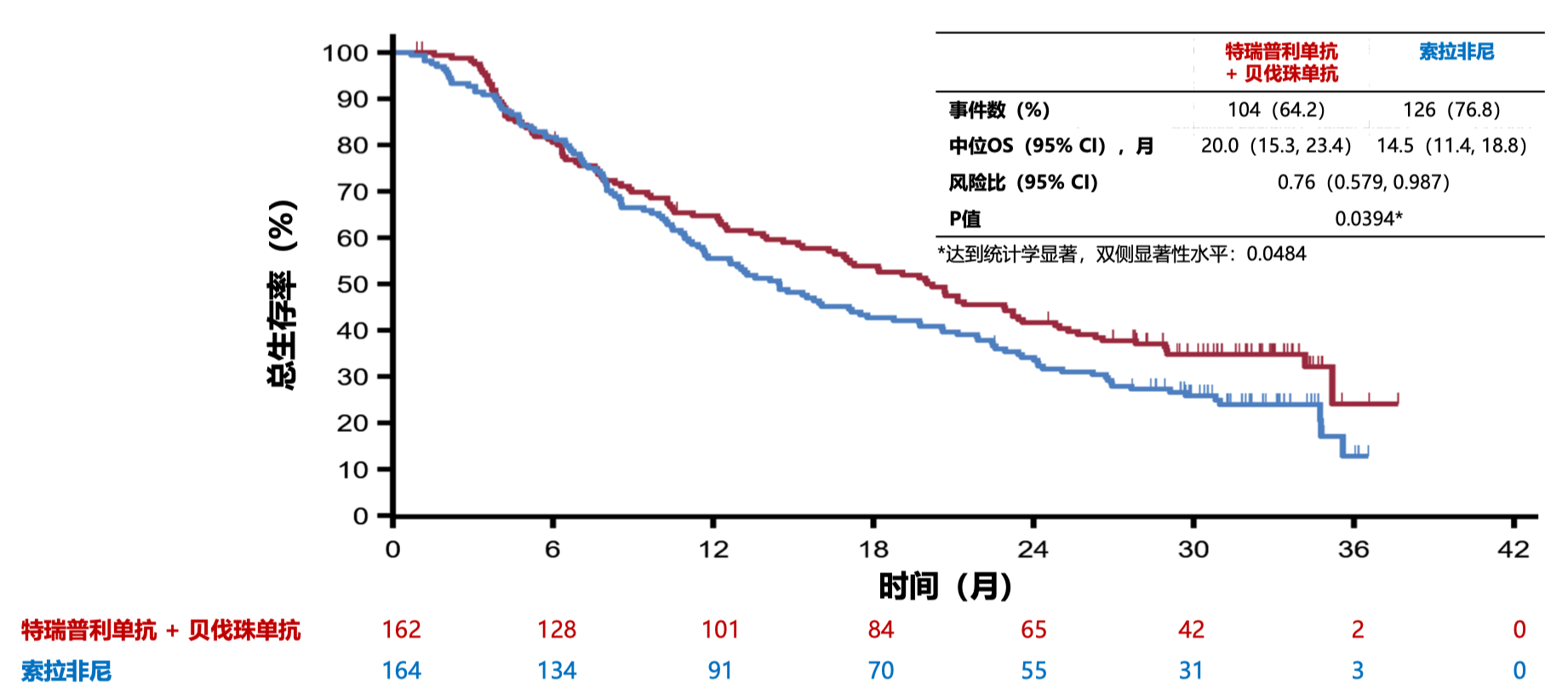
- 总生存期(OS)是最终分析,数据截⾄2024 年 5 月,中位随访时间 1 6.4⽉,OS 也显著改善(中位 OS 分别为 20.0 月和 14.5 月,HR=0.76,95%CI 0.579-0.987,P=0.0394),P 值低于显著性的α界值 0.0484。从生存曲线看,联合治疗组的生存优势在 6 个月后开始显示,此后一直保持。
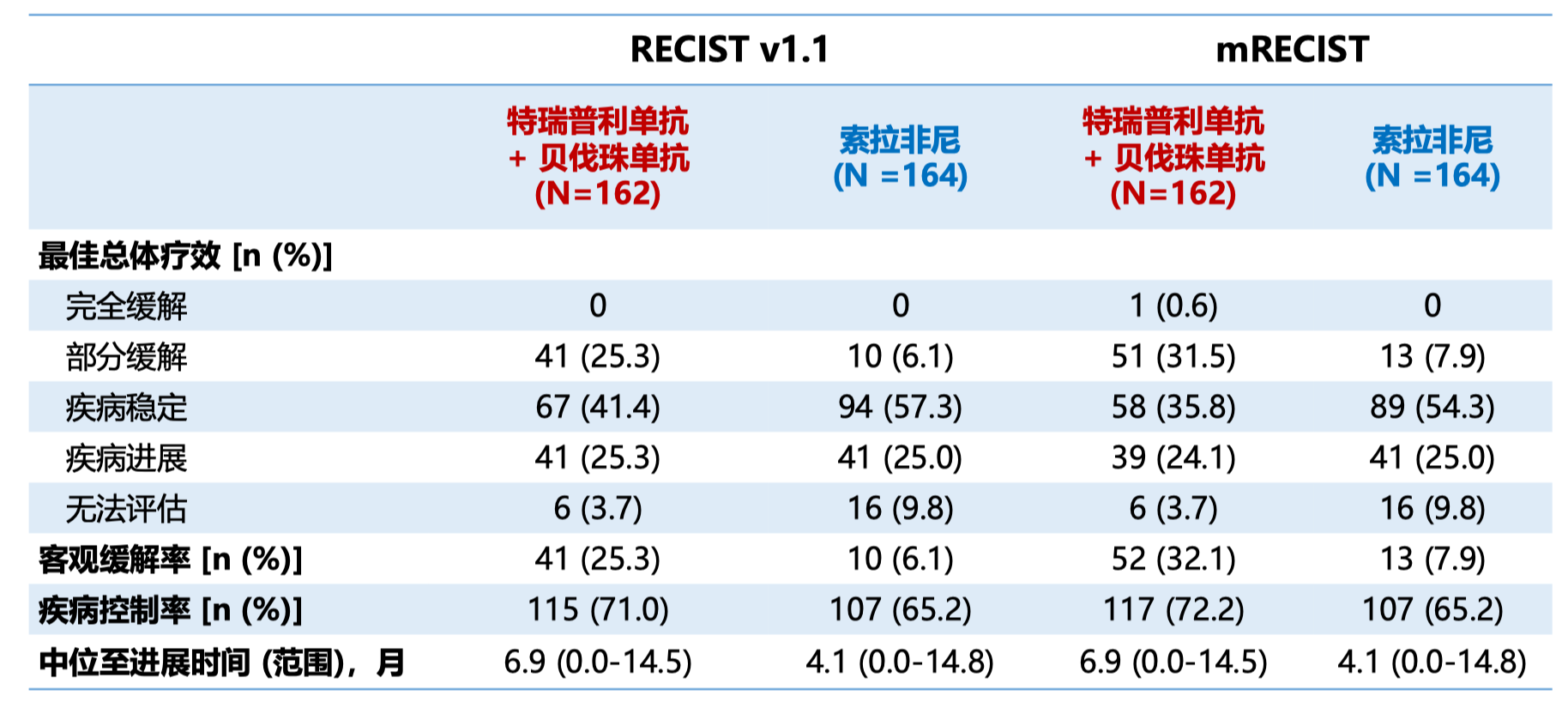
在所有的亚组分析中都显示出了联合治疗在 PFS 和 OS 方面的获益。 次要终点方面,RECIST v1.1 标准评估的客观缓解率(ORR)分别为 25.3% 和 6.1%,PD 率分别为 25.3% 和 25.0%。mRECIST 评估的 ORR 分别为 31.5% 和 7.9%,PD 率分别为 24.1% 和 25.0%。
联合治疗组和索拉非尼组的中位用药时间分别是 7 月和 4 月。不良反应方面,≥3 级治疗相关不良事件(TRAE)发生率分别为 45.7% 和 52.4%,治疗相关的 SAE 发生率分别为 22.2% 和 17.7%。如果按照暴露校正的 AE 来计算,联合治疗组的治疗耐受性要比索拉非尼好很多。
整体而言,特瑞普利单抗联合贝伐珠单抗治疗的疗效和安全性都符合我们的预期,跟目前已经在临床上广泛使用的“双达方案”(信迪利单抗联合贝伐珠单抗)基本一致。
这个治疗方案目前在等待监管部门的审批,此外还在等待审批的晚期肝癌一线治疗还包括神州细胞的相似组合,以及刚刚在 ESMO 会议上公布了研究结果的派安普利单抗联合安罗替尼(双安组合)。这些治疗方案与目前已经在临床上广泛应用的联合治疗(阿替利珠单抗+贝伐珠单抗、信迪利单抗+贝伐珠单抗、阿帕替尼+卡瑞利珠单抗)相比,在疗效数据上大同小异。但对于国内的肝癌患者而言,多了一个选择,治疗费用降低,总归是好事。未来, O+Y 和 STRIDE 方案的双免疫治疗也可能很快会获批上市,临床上针对患者的具体情况,做个性化的联合或续贯治疗,很有吸引力。
