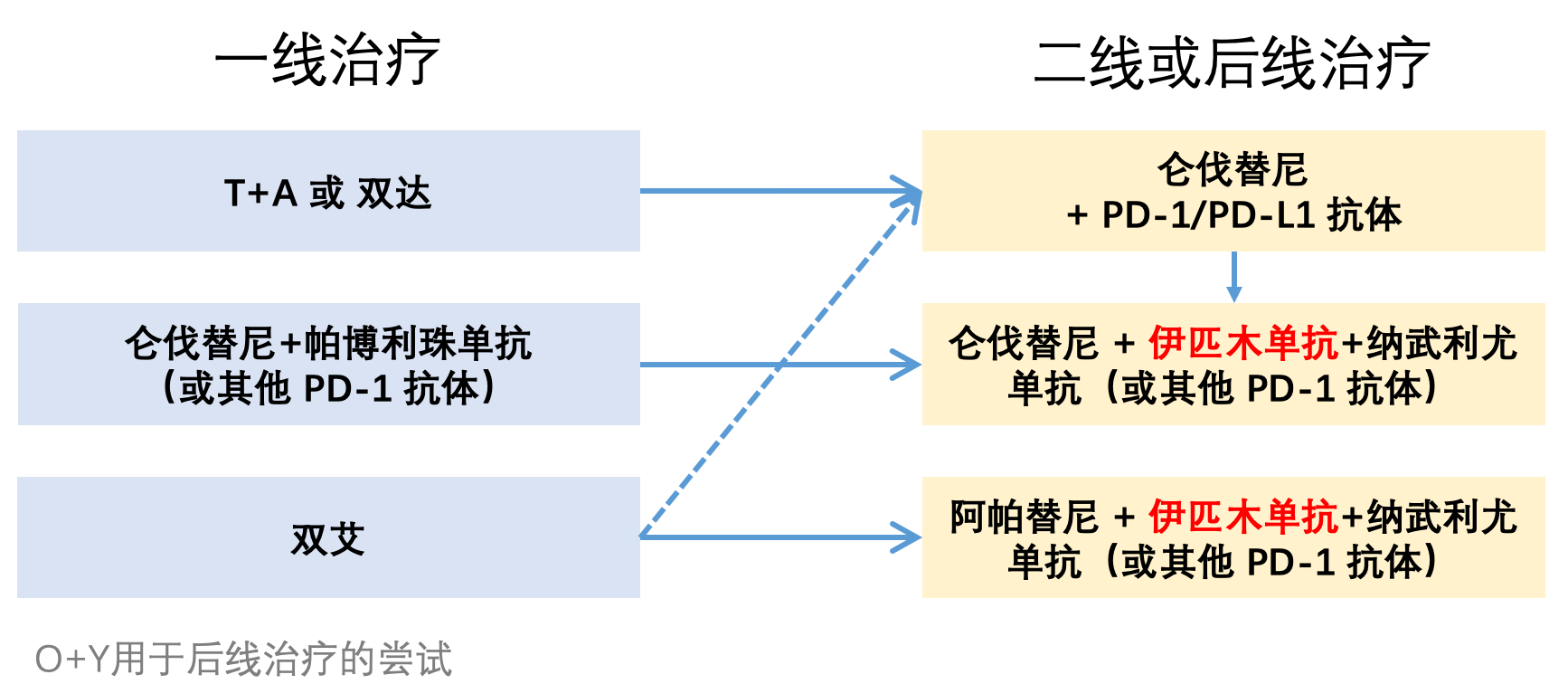
随着 [[HIMALAYA]](晚期肝癌一线治疗:STRIDE 方案 vs 索拉非尼) 和 [[CheckMate 9DW]](晚期肝癌一线治疗:O+Y 方案 vs 仑伐替尼或索拉非尼) 两项研究相继达到了主要研究终点,这两项 PD-1/PD-L1 抗体联合 CTLA-4 抗体的双免疫治疗在国内获批晚期肝癌一线治疗的适应证应该是迟早的事。STRIDE 方案(度伐利尤单抗+曲美木单抗)已经在国外多个国家或地区获批一线治疗适应证,O+Y 方案(纳武利尤单抗+伊匹木单抗)在美国具有二线治疗的适应证。
这两个方案虽然都是双免疫治疗,但用法差别还是挺大的,在疗效和不良反应方面的差异也非常大。两者用法的主要差异在于 CTLA-4 抗体用 1 个还是 4 个周期。
- STRIDE 方案(D+T): 曲美木单抗 300mg +度伐利尤单抗 1500mg ×1 周期,后续度伐利尤单抗 1500mg q4w 维持;
- O+Y 方案: 伊匹木单抗 3mg/kg+纳武利尤单抗 1mg/kg q3w ×4 周期,后续纳武利尤单抗 480mg q4w 维持。
目前,临床上晚期肝癌患者的首选治疗是靶向联合免疫治疗(TKI 或贝伐珠单抗联合 PD-1/PD-L1 抗体),那双免疫治疗到来之后,晚期肝癌的治疗格局会发生变化吗?
双免疫治疗的疗效和安全性
疗效
如果⚡️跨研究比较一下⚡️两个双免疫治疗方案,可以看到,在疗效方面,O+Y 方案的疗效会比 STRIDE 方案强很多。需要说明的是,因为不同的 III 期研究入组的患者存在差异,不同研究开展时的后线治疗也存在差异,所以跨研究比较需要警惕过度分析的可能。但因为全球多中心的 III 期研究的数据最为可靠,因此跨研究比较依然值得去做。
放在所有的晚期肝癌 III 期研究中,O+Y 的疗效数据也是目前最好的水平,包括中位 OS(23.7 月)、中位 PFS(9.1 月)和 ORR 数据(36%)都达到了联合治疗的最好数值。以仑伐替尼为主(占 85%)的 TKI 单药对照组的中位 OS 也达到了历史最长(20.6 月),LEAP-002 研究中仑伐替尼单药组的中位 OS 也有 19 月。
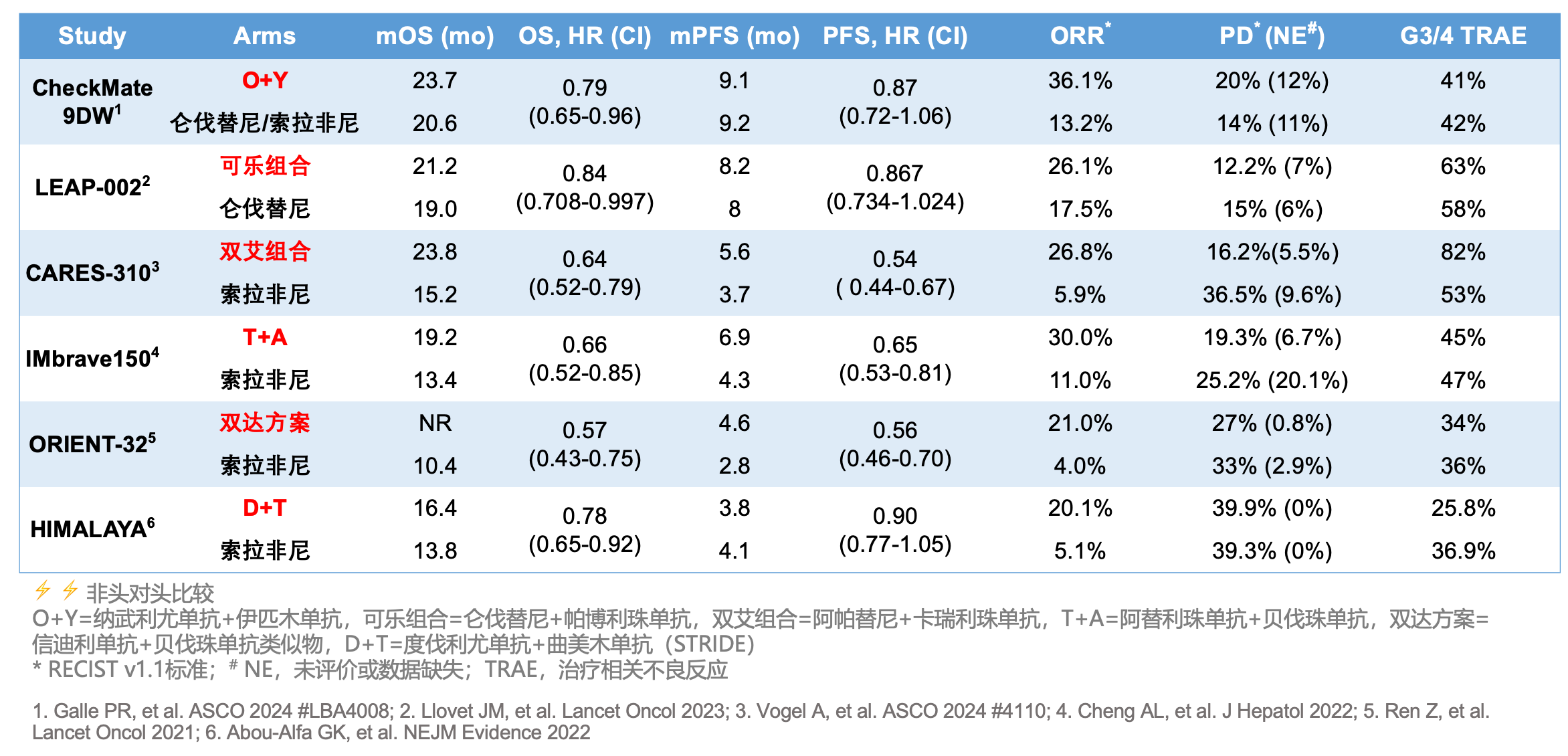
对疾病进展(PD)风险的担心。但是跟靶向联合免疫治疗相比,双免疫治疗的 PD 的发生率还是偏高。O+Y 方案虽然在数值上 PD 率 20%,但是考虑到有 12% 的患者没有接受影像评估(NE),这其中可能原因各异(不良反应导致过早出组?新冠疫情导致失访?)。但 O+Y 用于索拉非尼治疗失败的二线治疗的 ORR 有 40%,跟 HIMALA 研究中 STRIDE 方案用于晚期肝癌一线治疗的 PD 发生率一致。这些数据综合下来,晚期肝癌患者中可能存在较大的比例的患者对免疫治疗原发耐药。这些患者如果仅使用双免疫治疗,在首次影像评估的时候(往往是治疗后 2 月左右)就出现了明显的肿瘤增大,部分患者可能因此失去二线治疗的机会。例如,肿瘤负荷很大的患者,可能会因为肿瘤进一步增大导致肝肝功能受损,失去了后线抗肿瘤治疗的机会,导致预后不佳。
不良反应(AE)
O+Y 方案带来了更好疗效的同时,也带来了更多的不良反应,特别是致死的不良反应发生率达到了 4%,需要大剂量激素治疗的免疫相关不良反应高达 29%。与之相对应,STRIDE 方案对应的这两个数据分别为 2.3% 和 20.1%,显示了 CTLA-4 抗体使用次数更少之后带来了更少的不良反应。
此外,CheckMate 9DW 研究中,虽然数值上,3-4 级治疗相关不良反应(TRAE)的发生率在 O+Y 组和 TKI 组相当,分别是 41% 和 42%,但含义却不相同。TKI 的大部分不良反应可以通过减量或者停药缓解,而免疫治疗的不良反应处理起来要繁琐很多。免疫的不良反应跟它的疗效一样,拖尾效应非常明显,部分严重的不良反应需要大剂量激素冲击并且缓慢减量,治疗时间比较长,而且在国内就意味着需要住院治疗。
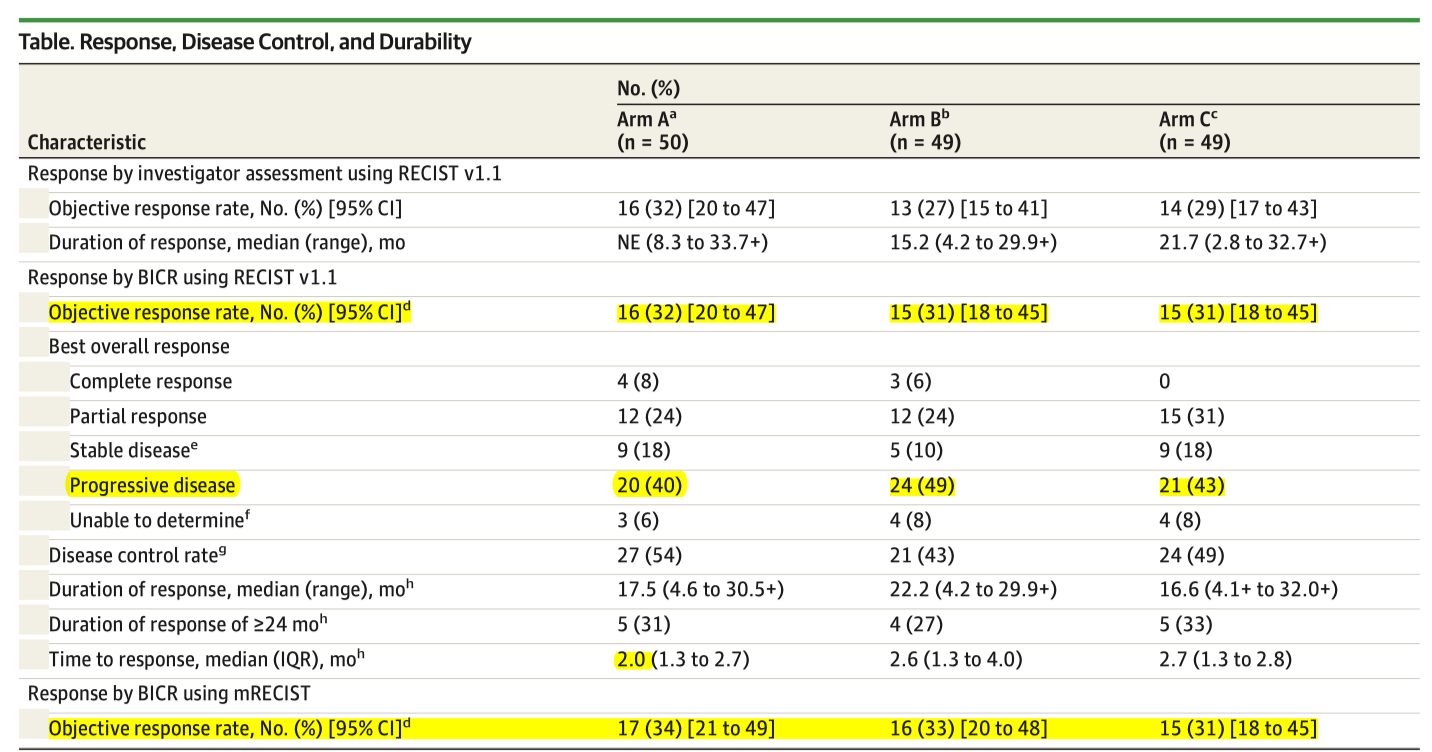
个人推测,在 O+Y 方案上市之后,临床医生可能会因为忌惮免疫相关不良反应或出于降低治疗费用考虑,降低 CTLA-4 的剂量或者治疗周期,从而减少免疫相关不良反应,这种“不规范”的用法可能反而会成为临床应用的主流。而前期的 [[CheckMate-040]] 研究中,使用低剂量的伊匹木单抗(Arm B:标准剂量纳武利尤单抗联合小剂量伊匹木单抗使用 4 周期后纳武利尤单抗维持治疗),抗肿瘤活性似乎没有明显下降,但 TRAE 发生率要低得多。
那该如何用?
双免疫用于一线治疗
- 不适合靶向治疗的患者:不适合贝伐珠单抗的患者比例不低,但完全不适合 TKI 治疗的比例其实相对较少。严重或未经治疗的食管胃底静脉曲张的患者存在贝伐珠单抗的使用禁忌,但这些患者用仑伐替尼则相对安全一点。但如果患者近期(如一个月内)有过各种原因引起的出血,使用仑伐替尼会担心再出血风险,使用免疫治疗则相对安全。此外,一些不能耐受靶向治疗不良反应的患者,例如不可控制的高血压、大量蛋白尿、血小板极低的患者,对免疫治疗的耐受性应该相对更好。
- 不用太担心进展后失去治疗机会的患者:对于部分肿瘤负荷较小或者不太担心肿瘤进展后威胁生命的患者(如肝外转移),可以考虑双免疫治疗作为一线治疗。如果治疗有效,预期将会长期获益,并且没有使用靶向治疗可以减少不良反应,从而维持最好的生活质量。
- 双免疫治疗联合靶向治疗:因为前述对双免疫治疗较高的 PD 率的担心,双免疫联合靶向药物,不管是联合贝伐还是仑伐,因为副作用不重叠,疗效人群可能也相互独立,所以可以考虑一线双免疫的基础上增加靶向治疗,可能可以进一步提高 ORR,降低 PD 率。
双免疫用于二线或更后线治疗
如前面的一篇文章的讨论,[[晚期肝癌一线治疗的选择]],目前使用 T+A(阿替利珠单抗+贝伐珠单抗) 或者双达方案(信迪利单抗+贝伐珠单抗类似物)进展的患者,还可以考虑将贝伐珠单抗更换成靶点更多的仑伐替尼或者阿帕替尼来治疗。双艾(卡瑞利珠单抗+阿帕替尼)进展后换用仑伐替尼,从机制上讲,少数患者可能也有效;而仑伐替尼联合 PD-1 抗体治疗进展的患者,换用别的靶向药往往很难奏效。对于这些患者,更换免疫可能是最为可行的选择。
这些接受过靶向联合免疫治疗的患者,可以考虑将 PD-1/PD-L1 抗体升级成双免疫治疗。已经有来自韩国、中国香港和美国的小型研究显示,一线接受过 PD-1 抗体治疗(联合或不联合靶向)的患者,二线选择伊匹木单抗联合 PD-1 抗体治疗,还有 16-22% 的 ORR。这个数值虽然不高,但比其他方案的有效率却高得多,而且免疫治疗一旦起效,预期会持续获益。
同样是出于对免疫治疗原发耐药的担心,靶向治疗建议维持到与双免疫治疗一同使用,以免出现停用靶向治疗之后的肿瘤快速进展。STRIDE 方案用于后线治疗的数据还缺乏,因此这里的双免疫特指 O+Y 或者伊匹木单抗联合其他 PD-1 抗体。因此,可以形成这样的后线治疗方式: