写在前面:这篇文章是面向医疗专业人士,并非面向病人。
这项研究的结果在去年的 ASCO 上已经公布出来了,现在进一步延长了随访,近期全文发表在 JCO 杂志上。
这是一项在日本开展的多中心研究(JCOG0603),入组的是仅仅出现了肝转移的结直肠癌患者(包括同时性和异时性肝转移),肝内肿瘤的数目不限,在接受根治性手术之后,按照 1:1 的比例接受术后辅助 FOLFOX6 方案辅助化疗(一共 8 个周期)(辅助化疗组)或者接受随访(单独手术组)。2007 至 2019 年期间,总共有 300 例患者接受了随机分组。在中期分析时,中位随访了 53.6 月,因为辅助化疗组的无复发生存期(DFS)显著优于单独手术组,所以研究被暂停。目前报道的是中位随访 59.2 月时的结果,两组患者的 5 年 DFS 分别为 49.8% 和 38.7%(HR=0.67,95% CI 0.50 to 0.92,单边 P=0.006)。也就是说,辅助化疗显著减少了 10% 的肿瘤复发。但是,有意思的地方来了,5 年的 OS 在两组分别为71.2% 和 83.1% (HR=1.25,95% CI 0.78-2.00)。你没有看错,辅助化疗组的 OS 在数值上比不上单独手术。
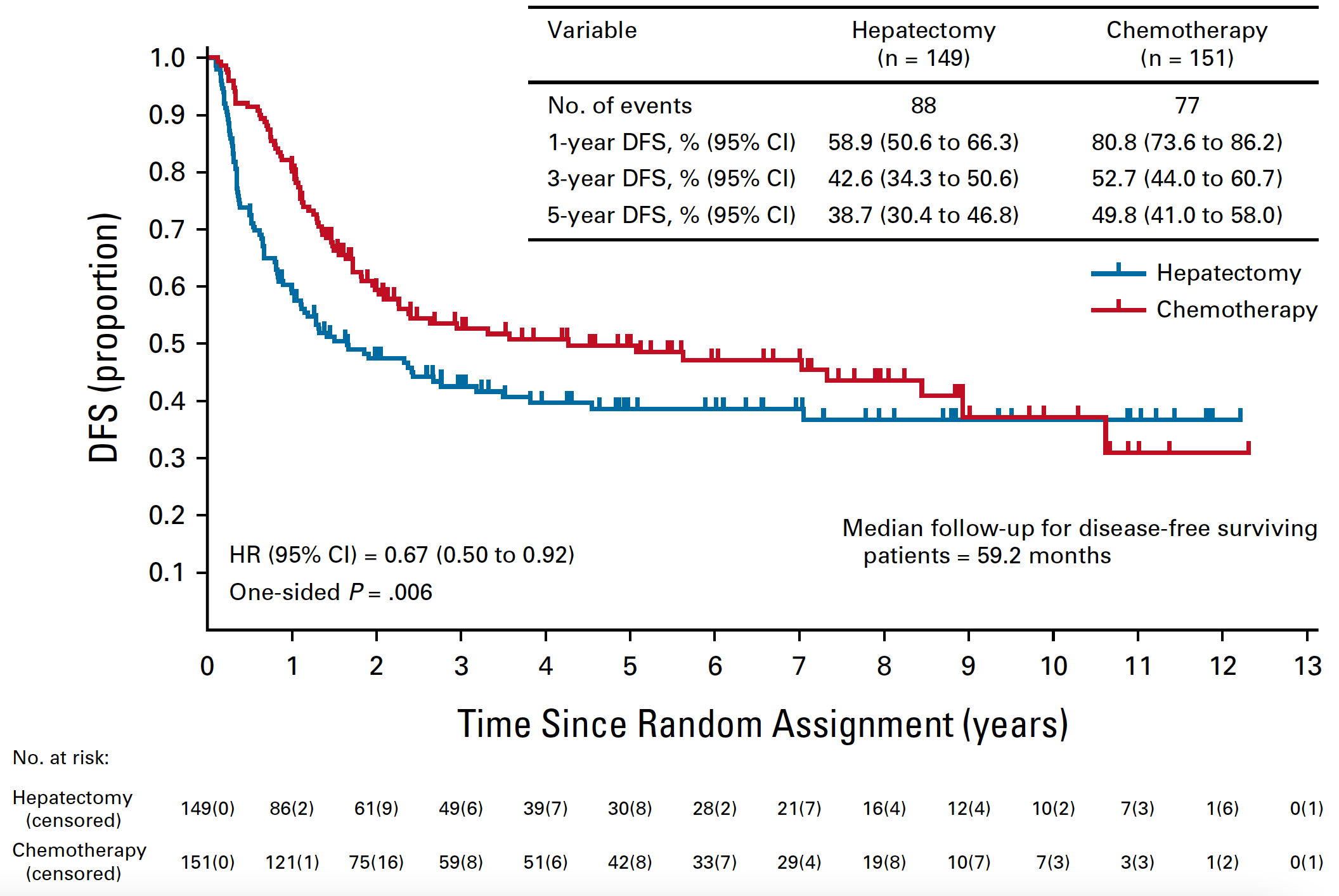
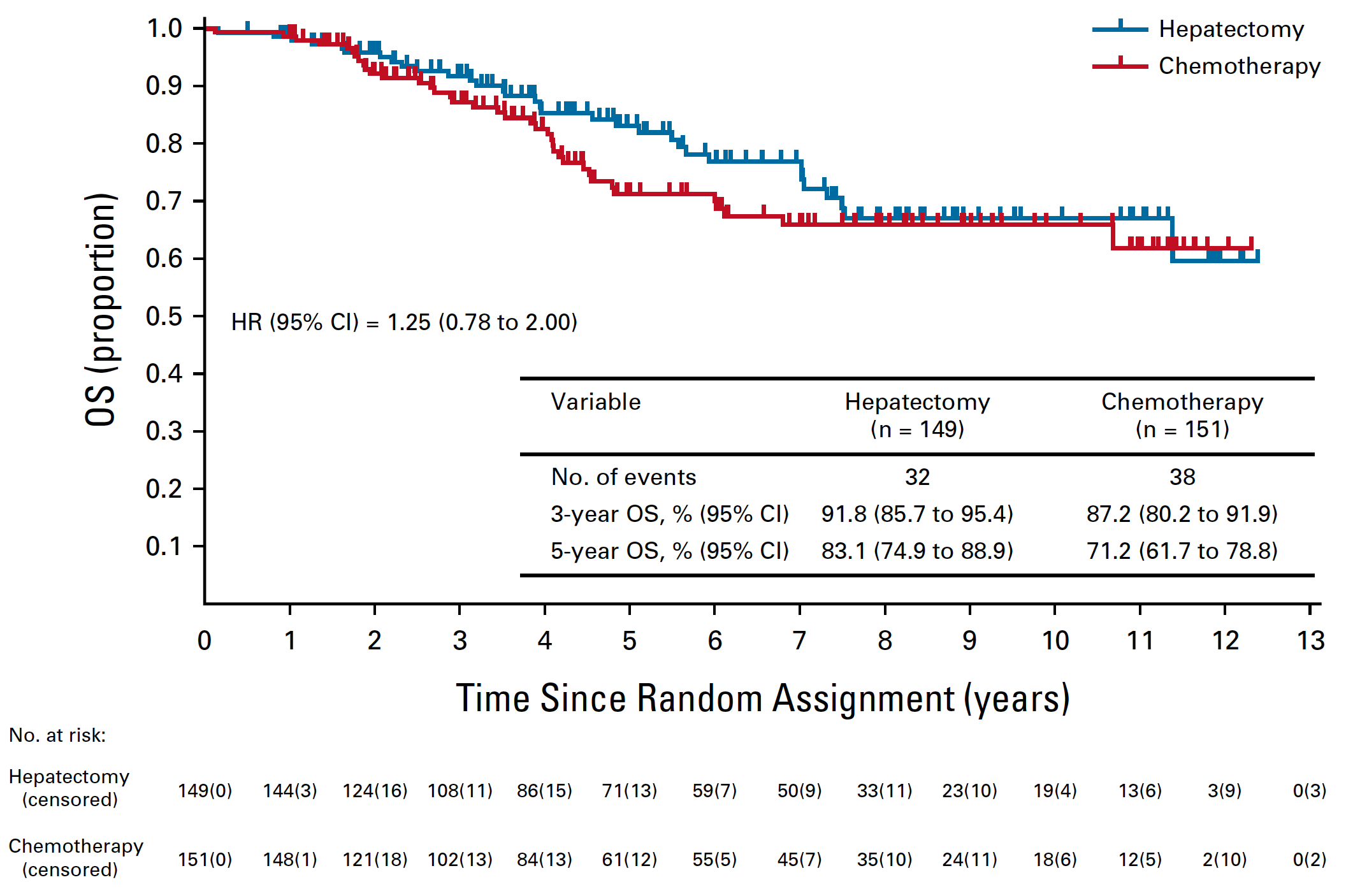
那什么原因导致了 DFS 改善,而 OS 方面没有获益呢?尽管 DFS 的生存曲线从随机后一开始就出现了两组之间的分离,而且可持续至 5 年,也就是说辅助化疗预防复发的作用是非常确切的。但是 OS 的曲线,从随机 2 年以后也开始出现分离,并且单独手术组一直处在辅助化疗组之上。这是否意味着化疗带来的一些后果可能会导致患者的过早死亡,抵消了预防复发方面带来的获益。 当然,OS 数据因为没有在统计学上形成显著差异,如果说辅助化疗缩短的患者的生存期,这就是过度解读了。安全性方面,虽然 FOLFOX6 化疗整体比较温和,但 G3 及以上不良事件发生率比较高,光中性粒细胞减少就占 50%,感觉神经病变占 10%,过敏反应占 4%。
那为什么辅助化疗组的患者在 OS 上至少没有优于单独手术组呢?
进一步的分析发现,化疗组的患者复发后的生存时间更短了。 这可以有多方面的解释:
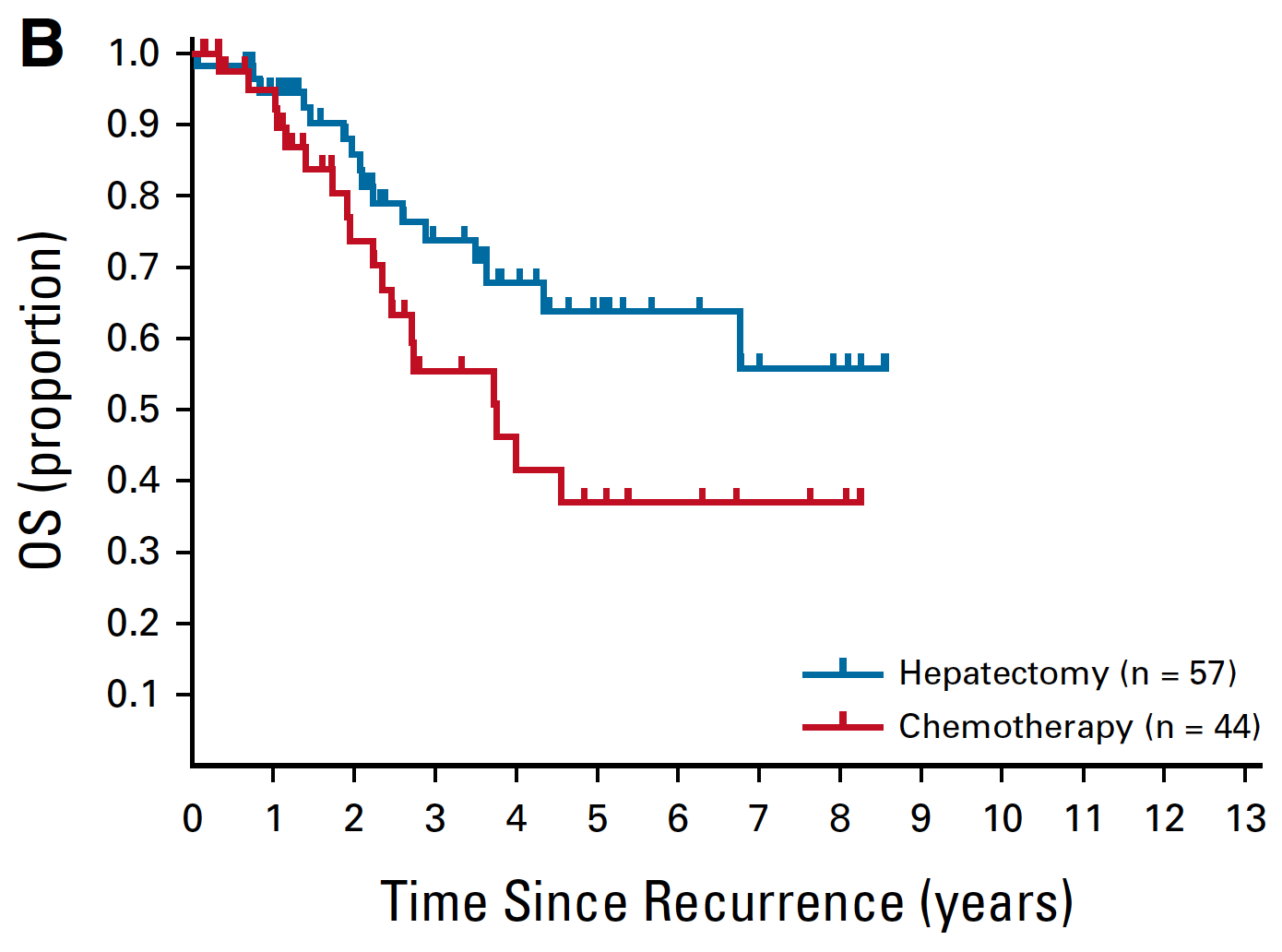
- 因为 FOLFOX6 方案本身是晚期肠癌的优选的化疗方案,将这个方案用于预防复发有些浪费。 而预防性的使用过这个方案的患者,因为铂类的最大累积剂量达到了或者已经诱发出了治疗耐药,就需要放弃这个一线治疗方案,从而可能会导致复发后的生存时间更短。肿瘤复发之后,辅助化疗组的患者使用的二线化疗中,铂类的使用的比例比单独手术组低 20%。此外,从机理上讲,患者在没有出现临床复发之前,将优选的化疗方案用来对付微转移灶,可能诱发出了治疗耐药。而患者复发之后,这一化疗方案也就没法再用了或者即使使用,效果也不佳。
- 复发后的特征和治疗也存在差别。 辅助化疗组肝内复发的比例较低 (37% vs 51%),但远处转移的比例更高(63% vs 48%)。而辅助化疗组的患者接受再次手术的比例较低(53% vs 60%)。至于为什么辅助化疗组接受再手术的比例较低原因不详,也许是化疗引起的全身和肝脏情况变差,也是是因为肺及其他器官的转移通过手术难以 R0 切除。为什么辅助化疗组肝内复发比例较低,研究者做了一个非常大胆的假设:化疗会引起的脂肪肝,从而增加了 CT 检查检出肝内复发灶的难度,进而会误以为化疗减少了肝内复发和总的复发率,但其实已经有了肝内复发,只是没有检测出来。如果按照这种说法,DFS 方面的获益的结果也显得不可靠。
那回到临床问题,对于接受了 R0 手术的肠癌肝转移患者,是否还需要术后辅助化疗?我的观点是决定于患者的情况:
- 如果肝内肿瘤多发,特别是 ≥4 枚肝内病灶的患者,手术之后,患者肝脏内仍大概率地存在残留病灶,可以需要考虑辅助化疗。 这项研究里入组的患者肝内转移灶的数目相对较少,≥4 枚的患者只有 10% 不到。因此,对于肝内病灶特别多的患者是否需要辅助化疗,从这项研究里还得不到结论。手术过程中,我们也需要力争使用敏感的方法寻找到所有的肿瘤病灶,例如使用示卓安的超声造影剂可以帮助发现微小的肝转移灶(这一方法在日本早就常规使用);
- 如果患者出现了提示复发的高危因素,例如癌胚抗原、糖链抗原 19-9 的持续升高,提示大概率有肿瘤在机体某个部位有残留的话,辅助化疗也需要考虑。
基于这项研究,对于肝内病灶不超过 3 枚的肠癌肝转移患者,如果不存在其他高危因素,我建议还是暂缓化疗,让患者在手术之后度过一段生活质量比较高的无化疗、无瘤生存时间。尽管化疗可以减少 10% 的复发,但因为总生存期没有改善,这减少的复发率也就没有了临床价值。
